Laboratorio di
Microbiologia Generale
a cura di Gabriele Giliberti

Tecnica dell’antibiogramma
La crescita dei microrganismi può essere controllata mediante
l’uso di agenti antimicrobici,
composti chimici naturali o di sintesi che uccidono i microrganismi o ne
inibiscono la crescita; tuttavia la distinzione tra la capacità di un composto
di determinare la morte o l’inibizione della crescita di microrganismi è spesso
arbitraria, in quanto lo stesso composto può essere letale ad alte concentrazioni,
mentre a basse concentrazioni può limitarsi ad avere effetto inibente. Agenti
antimicrobici dotati di tossicità selettiva contro i batteri sono
particolarmente utili come chemioterapici per il trattamento delle malattie
infettive, in quanto possono essere usati per uccidere i microrganismi patogeni
senza danneggiare l’ospite. Nell’ambito degli agenti antimicrobici, si
distinguono: i disinfettanti, agenti che uccidono gli organismi e che non
possono essere utilizzati sui tessuti viventi, bensì su tavoli, pavimenti,
utensili; gli agenti chemioterapici, di origine sintetica utili nel trattamento
di malattie batteriche o virali; gli antibiotici,
prodotti dai microrganismi, che uccidono o inibiscono la crescita di altri
microrganismi. L’attività antimicrobica si misura determinando la più piccola
concentrazione del composto in esame necessaria per inibire la crescita di un
dato organismo; tale concentrazione viene chiamata minima concentrazione
inibente (MIC). Una procedura utilizzata per valutare la sensibilità agli
antibiotici di un ceppo batterico è il metodo per diffusione in terreno
agarizzato (tecnica dell’antibiogramma
o di Kirby-Bauer). La piastra di terreno agarizzato viene inoculata con il
microrganismo in modo che si formi uno strato superficiale sottile. Dischetti
di carta da filtro, intrisi di antibiotici, vengono depositati poi sulla
superficie del terreno agarizzato. In questo modo, durante l’incubazione, il
composto diffonde creando un gradiente di concentrazione: quanto più ci si
allontana dal dischetto tanto minore sarà la sua concentrazione, fino al punto
in cui si raggiungerà la MIC. Al di là di questo punto si avrà crescita
confluente, mentre nella zona più vicina al dischetto non si osserverà crescita
(alone di inibizione). Il diametro
dell’alone di inibizione è direttamente proporzionale al grado di
suscettibilità del microrganismo in coltura e fornisce quindi l’indicazione
della suscettibilità o della resistenza verso l’antibiotico specifico
utilizzato. Il pattern di suscettibilità verso i diversi antibiotici è definito
antibiogramma. L’importanza
dell’antibiogramma si basa sul principio che la sensibilità in vitro prefigura
l'efficacia in vivo della terapia antibiotica; il test di sensibilità agli
antibiotici serve non solo per orientare la terapia antibiotica, ma anche per
monitorare l’evoluzione della resistenza batterica e dare quindi le basi del
trattamento empirico delle infezioni batteriche. Molti test di laboratorio non
misurano la MIC ma una stima della MIC semiquantitativa. Questa stima meno
accurata della MIC è data da 2 concentrazioni di antibiotico note come breakpoints che determinano le 3
seguenti categorie: S (Sensibile, significa che l’infezione può essere trattata
con quell’antibiotico al dosaggio usuale); I (Intermedia, l’infezione può
essere trattata con quell’antibiotico a un dosaggio leggermente più alto di
quello usuale); R (Resistente, ceppi resistenti non inibiti dalle
concentrazioni sistemiche dell’antibiotico ai dosaggi normali e anche a quelli
più alti). Spesso nell’antibiogramma si testano antibiotici che non hanno
alcuna importanza terapeutica come l’oxacillina. L’oxacillina è un marker di
resistenza nel caso degli stafilococchi. La resistenza alla oxacillina
prefigura una resistenza più estesa ad alcune classi di antibiotici quali
penicilline, chinoloni, aminoglicosidi e i macrolidi. Per l’esercitazione si
utilizzano Escherichia coli e Staphylococcus aureus, potenzialmente
patogeno come già discusso, per cui l’apertura della coltura liquida e lo
spatolamento su piastra vanno eseguiti sotto una cappa di sicurezza biologica a
flusso verticale.
Protocollo sperimentale
ü
Preparare 4 piastre di terreno
solido Muller-Hinton agar, sciogliendo in 100 ml di acqua distillata l’opportuna
quantità di polvere e sterilizzando in autoclave.
ü
Lasciar raffreddare le piastre di
terreno agarizzato.
ü
Prelevare 0.2 ml da una brodocoltura
di Staphylococcus aureus e
distribuirli sulla superficie di ciascuna piastra con una spatola monouso.
ü
Chiudere le piastre e lasciare asciugare
per qualche minuto.
ü
Prelevare con pinzette sterili i
dischetti contenenti gli antibiotici per stafilococchi e streptococchi [Fig. 1].
ü
Appoggiare i dischetti sulla piastra
a una distanza di almeno 15 mm dal bordo della piastra, evitando di strisciarli
sul terreno [Fig. 2].
ü
Utilizzando le pinzette, far aderire
perfettamente i dischetti al terreno.
ü
Ripetere tutta l’operazione con la
brodocoltura di Escherichia coli,
impiegando i dischetti contenenti gli antibiotici per enterobatteri Gram- urinari.
ü
Incubare a 37°C per 18-24 ore.
ü
Osservare gli aloni di inibizione
originatisi sulle piastre incubate con E.
coli e S. aureus [Fig. 3].
ü
Misurare con un righello l’alone di
inibizione per ciascun antibiotico, completando la tabella sottostante e
individuando verso quali antibiotici gli organismi testati risultano
suscettibili.
|
Antimicrobial agent |
R = mm or less |
I = mm |
S = mm or more |
Alone misurato |
|
erythromycin |
13 |
14-22 |
23 |
|
|
amoxicillin/clavulanic acid - Staphylococcus |
19 |
- |
20 |
|
|
sulfamethoxazole + trimethoprim (co-trimoxazole) |
10 |
11-15 |
16 |
|
|
ciprofloxacin |
15 |
16-20 |
21 |
|
|
imipenem |
13 |
14-15 |
16 |
|
|
mezlocillin |
12 |
13-15 |
16 |
|
|
cefoperazone |
15 |
16-20 |
21 |
|
|
penicillin |
28 |
- |
29 |
|
|
Antimicrobial agent |
R = mm or less |
I = mm |
S = mm or more |
Alone misurato |
|
ceftazidime |
14 |
15-17 |
18 |
|
|
sulfamethoxazole + trimethoprim (co-trimoxazole) |
10 |
11-15 |
16 |
|
|
gentamicin |
12 |
13-14 |
15 |
|
|
norfloxacin |
12 |
13-16 |
17 |
|
|
netilmicin |
12 |
13-16 |
17 |
|
|
nitrofurantoin |
14 |
15-16 |
17 |
|
|
cefoperazone |
15 |
16-20 |
21 |
|
|
imipenem |
13 |
14-15 |
16 |
|

Fig. 1:
dischetti imbevuti di antibiotici da posizionare sulle colture batteriche.
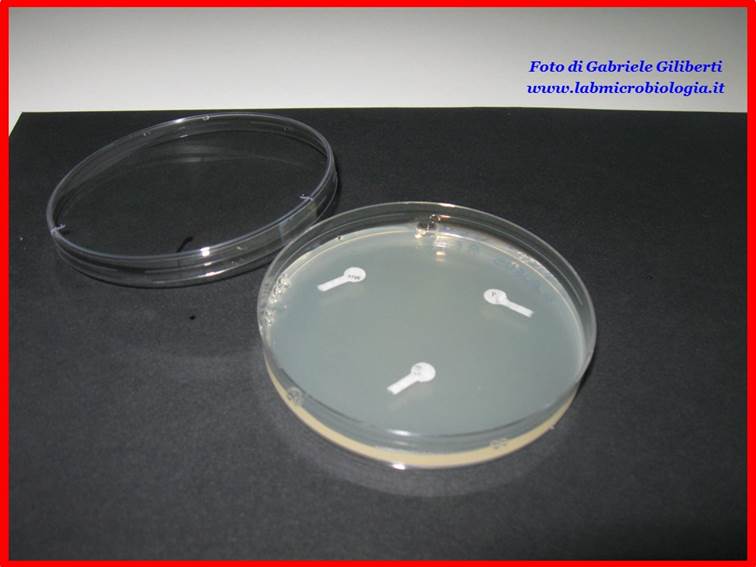
Fig. 2:
dischetti di antibiotico posizionati sulle piastre contenenti le colture
batteriche.
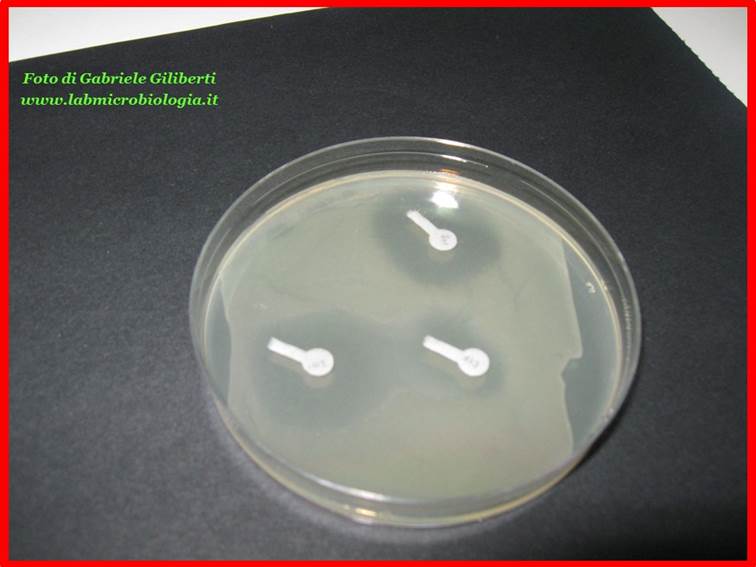
Fig. 3: aloni
di inibizione sviluppati sulle piastre dopo l’incubazione a 37°C.



