Laboratorio di
Microbiologia Generale
a cura di Gabriele Giliberti

Colorazione di Gram
Nel 1883 il fisico danese Gram
scoprì che i batteri sono distinguibili in due grandi categorie. Effettuando
infatti una colorazione con cristal violetto,
seguita da un trattamento con una soluzione iodo-iodurata e con un agente
decolorante, vide che un gruppo di cellule resisteva alla rimozione del cristal
violetto, mentre un altro gruppo si decolorava rapidamente. Le cellule che
conservano il cristal violetto risultavano blu e sono dette Gram-positive; quelle che perdono la
colorazione blu sono dette Gram-negative
e risultano rosa se esposte all’azione di un colorante di contrasto quale la
safranina. Oggi sappiamo che i due tipi cellulari si colorano differentemente per
la presenza di una diversa organizzazione della parete: i batteri Gram-negativi
infatti presentano uno strato più sottile di peptidoglicano che viene colorato
con intensità minore e che può essere più facilmente attraversato dal
decolorante. Quando vengono utilizzati due o più coloranti ed altri reagenti
come mordenzanti, come nel caso della colorazione di Gram, si parla di colorazione differenziale, in grado
cioè di distinguere tra differenti tipologie di microrganismi o differenti
strutture di un microrganismo. La colorazione di Gram rappresenta la
colorazione differenziale maggiormente utilizzata e importante in
batteriologia. I batteri (ad esempio bacilli come Escherichia coli o Bacillus
subtilis) prelevati da una coltura in fase esponenziale vengono fissati al
vetrino e colorati con cristal violetto; il vetrino viene poi trattato con una
soluzione di iodio che agisce da mordenzante, facilita cioè la colorazione
attraverso la formazione di un complesso che precipita all’interno della
cellula. Il successivo lavaggio con una miscela di etanolo e acetone lava via
il colorante dai batteri Gram-negativi che diventano incolori; l’utilizzo poi
di un colorante di contrasto (safranina) permette una nuova colorazione dei
Gram-negativi.
Protocollo sperimentale
ü
Prelevare 5µl da una coltura liquida
di batteri Gram-positivi (Bacillus
subtilis) e da una coltura di batteri Gram-negativi (Escherichia coli) e deporli al centro di un vetrino portaoggetti.
ü
Distribuire la sospensione batterica
sul vetrino in modo da formare un sottile film.
ü
Fissare il preparato passando il
vetrino due o tre volte su una fiamma.
ü
Mettere il vetrino in una vaschetta
per la colorazione.
ü
Coprire l’area del vetrino dove sono
presenti le cellule fissate con una goccia di cristal violetto (colorante
primario) e far agire per circa 1 minuto.
ü
Lavare con acqua distillata per
rimuovere il colorante in eccesso, aiutandosi eventualmente con carta
assorbente per asciugare i bordi del vetrino.
ü
Coprire l’area del vetrino dove sono
presenti le cellule con la soluzione di iodio e far agire per circa 1 minuto.
ü
Lavare con acqua distillata per
pochi secondi.
ü
Decolorare con alcool
etilico/acetone 1:1 versandolo con una pipetta Pasteur fino a quando non
sparisce il colore porpora.
ü
Lavare con acqua distillata per pochi
secondi.
ü
Coprire l’area del vetrino dove sono
presenti le cellule fissate con una goccia di safranina (colorante secondario)
e far agire per circa 1 minuto.
ü
Lavare con acqua distillata per
rimuovere il colorante in eccesso, aiutandosi eventualmente con carta
assorbente per asciugare i bordi del vetrino.
ü
Far asciugare il preparato all’aria
o passando il vetrino su una fiamma.
ü
Osservare il vetrino al microscopio,
aumentando progressivamente l’ingrandimento fino ad utilizzare l’obiettivo ad
immersione (100x) [Fig. 2 e 3].
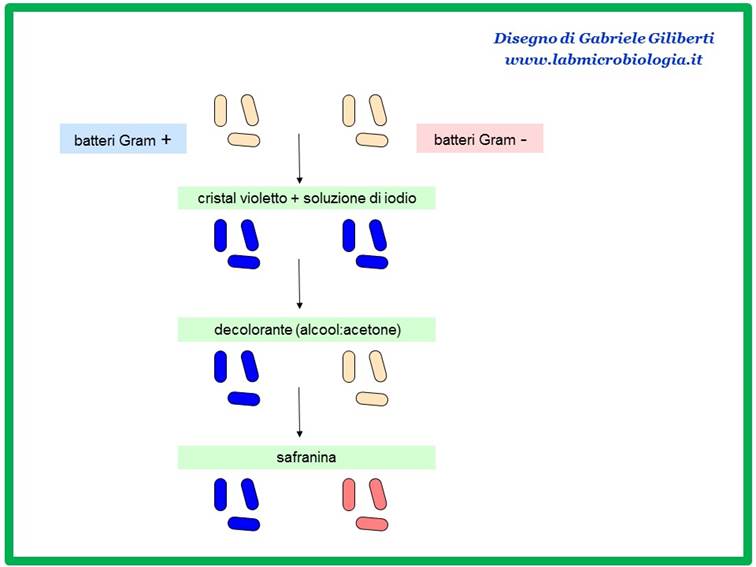
Fig. 1: schema
riassuntivo della colorazione di Gram.
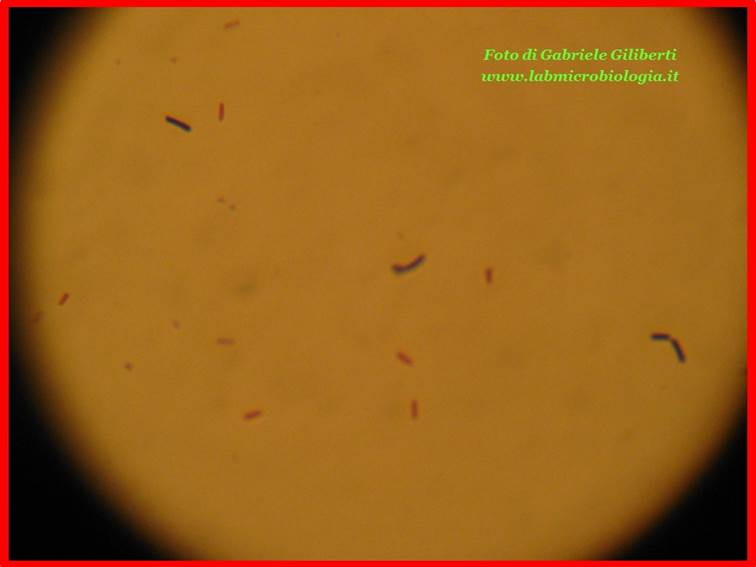
Fig. 2: osservazione
al microscopio (ingrandimento 1000x) di cellule di cellule di B. subtilis
(Gram+) e E. coli (Gram-).
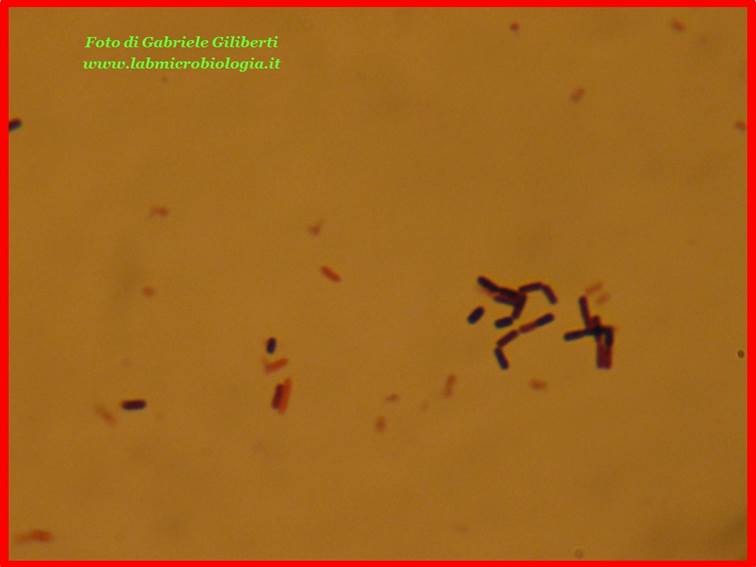
Fig. 3: osservazione
al microscopio (ingrandimento 1000x) di cellule di cellule di B. subtilis
(Gram+) e E. coli (Gram-).



