Laboratorio di
Microbiologia Generale
a cura di Gabriele Giliberti

Curva di crescita batterica
La crescita di una coltura batterica a termine, effettuata cioè
in un volume definito di terreno come quelle normalmente effettuate in
laboratorio, è caratterizzata dalla successione di quattro fasi. Prima che i
batteri inizino a duplicarsi, quando vengono trasferiti in condizioni di
crescita diverse da quelle di partenza, è necessario che sintetizzino tutti gli
enzimi e coenzimi necessari per la crescita; questa fase di adattamento in cui
non si duplicazione cellulare è definita latenza.
Poi i batteri iniziano a duplicarsi velocemente in maniera esponenziale,
sfruttando al massimo le risorse disponibili (fase esponenziale). Il progressivo esaurimento delle risorse
disponibili e l’accumulo di prodotti di rifiuto determinano poi la fine della
fase esponenziale e l’ingresso nella fase
stazionaria di crescita, in cui si ha un equilibrio tra cellule in
divisione e cellule che iniziano a morire, per cui il numero di cellule in
coltura rimane costante. La coltura entra infine in una fase di morte massiva,
che può essere caratterizzata o meno da lisi cellulare. Un metodo veloce e non
distruttivo per seguire una curva di crescita batterica, al fine ad esempio di
determinarne il tempo di generazione, è la turbidometria.
Un terreno contenente un inoculo batterico infatti con il procedere della
crescita diventa progressivamente più torbido e tale aumento di torbidità è
proporzionale al numero di cellule presenti (per gli organismi unicellulari).
La misura della torbidità è una misura indiretta della biomassa, ma durante la
fase logaritmica di crescita può essere correlata al numero di cellule in
coltura. Viene effettuata da uno strumento, lo spettrofotometro, in grado di
rilevare la percentuale di luce trasmessa da una coltura batterica
(trasmittanza) se attraversata da un fascio di luce incidente; il valore viene
espresso in termini di assorbanza
(inverso della trasmittanza) ed è proporzionale all’aumento di cellule nella
coltura. Riportando i dati di assorbanza in funzione logaritmica del tempo si
può costruire una curva di crescita
che permette di individuare le diverse fasi di crescita e di determinare il
tempo di generazione del microrganismo in questione. Ogni specie batterica ha
un intervallo di temperature all’interno del quale è in grado di crescere e
riprodursi che è determinato dalla diversa sensibilità di enzimi ed altri
componenti cellulari al caldo e al freddo; all’interno di tale intervallo vi è
poi una temperatura ottimale di crescita alla quale i microrganismi si
riproducono con il tempo di generazione minore. Anche il pH è un fattore che
influenza fortemente la crescita batterica, alterando la funzionalità degli
enzimi coinvolti nel metabolismo. I parametri che influenzano la crescita e il
cui effetto viene misurato in questa esperienza sono la temperatura, il pH e
l’agitazione che permette l’ottimale distribuzione di ossigeno e nutrienti
nella coltura di Escherichia coli,
utilizzato per il suo tempo di generazione corto.
Protocollo sperimentale
ü
Preparare 4 beute sterili da 250 ml
con 25 ml di terreno di coltura LB liquido in ciascuna beuta.
ü
Siglare le beute con le condizioni
di crescita da utilizzare: 1) 37°C - pH 7.0 - agitazione; 2) 25°C - pH 7.0 - agitazione;
3) 37°C - pH 7.0 - senza agitazione; 4) 37°C - pH 5.0 - in agitazione.
ü
Preriscaldare le beute con i terreni
alle rispettive temperature di utilizzo.
ü
Prelevare 1 ml da una coltura
liquida di Escherichia coli e
addizionarla a 9 ml di terreno LB (diluizione 1:10).
ü
Agitare e aliquotare 1 ml della
diluizione in una cuvetta [Fig. 1].
ü
Preparare una seconda cuvetta
contenente 1 ml di LB da utilizzare per l’azzeramento dello spettrofotometro.
ü
Leggere allo spettrofotometro la
densità ottica a 600nm (DO600).
ü
Moltiplicare il valore letto dallo
strumento per 10, in modo da ottenere la DO600 della coltura di
partenza.
ü
Effettuare un inoculo della coltura
batterica iniziale nei diversi terreni di coltura preparati, diluendo la
coltura di partenza fino ad una DO600 di 0.1.
ü
Calcolare il volume di coltura
iniziale da inoculare in ciascuna beuta, utilizzando la formula: 0.1 × 25 ml /
DO600 (coltura iniziale).
ü
Prelevare con una pipetta la
quantità di coltura iniziale da inoculare (determinata al punto precedente) e aggiungerla
alle diverse beute.
ü
Prelevare 1 ml da ciascuna coltura e
trasferirlo in una cuvetta per leggere la DO600 iniziale (punto t0).
ü
Incubare le beute alle diverse
condizioni: 1) a 37°C in agitazione; 2) a 25°C in agitazione; 3) a 37°C senza
agitazione; 4) a 37°C in agitazione [Fig. 2].
ü
Dopo 60 minuti prelevare 1 ml di
ciascuna coltura e trasferirlo in una cuvetta per leggere la DO600
(punto t1).
ü
Ogni 30 minuti prelevare 1 ml di
ciascuna coltura e trasferirlo in una cuvetta per leggere la DO600
(punti t2-3-4-5-6).
ü
Annotare tutte le letture in una
tabella [Fig. 3].
ü
Costruire le diverse curve di
crescita, riportando in grafico la DO600 in funzione del tempo [Fig.
4].

Fig. 1: trasferimento
di un’aliquota di coltura batterica dalla beuta alla cuvetta per la lettura
allo spettrofotometro.

Fig. 2: termostato
a 37°C con agitazione per la crescita di E. coli.
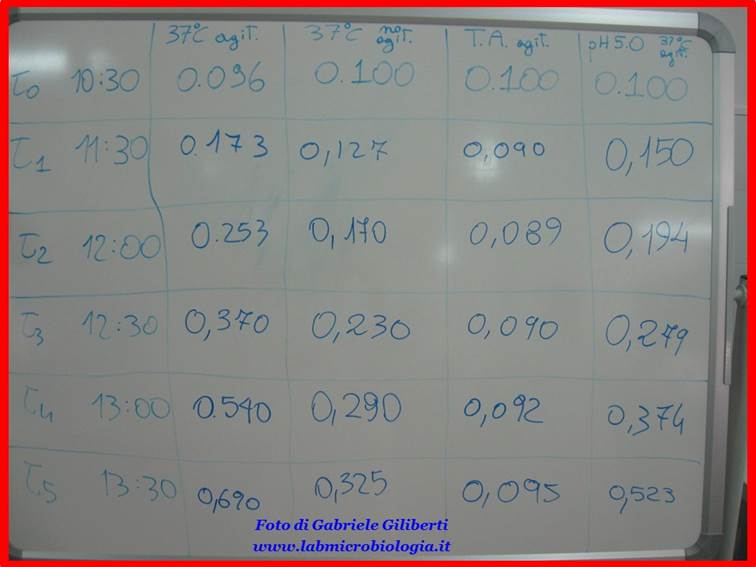
Fig. 3: dati
di densità ottica a 600nm raccolti durante la crescita di E. coli in diverse
condizioni di crescita.
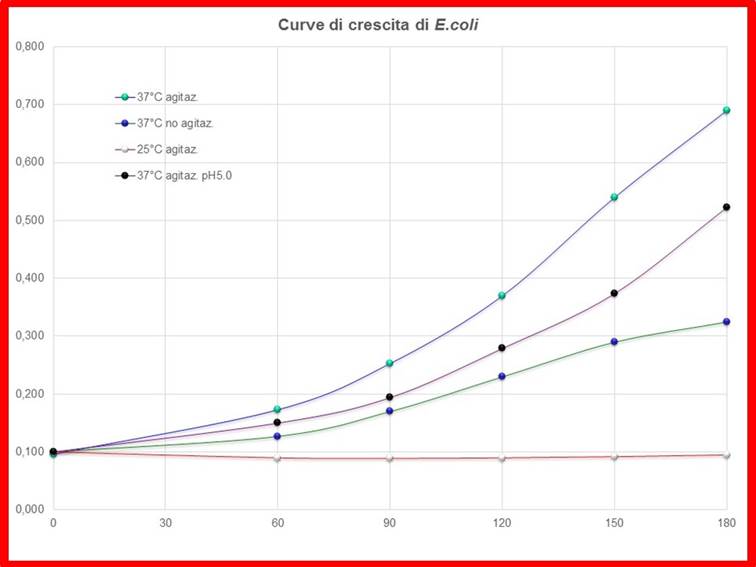
Fig. 4:
curve di crescita ottenute con i dati delle DO600 in funzione dei
minuti.



